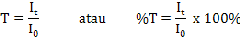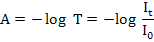Spektrofotometri
merupakan salah satu metode dalam kimia analisis yang digunakan untuk
menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif
yang didasarkan pada interaksi antara materi dengan cahaya. Peralatan
yang digunakan dalam spektrofotometri disebut spektrofotometer.
Cahaya yang dimaksud dapat berupa cahaya visibel, UV dan inframerah,
sedangkan materi dapat berupa atom dan molekul namun yang lebih berperan
adalah elektron valensi.
Sinar
atau cahaya yang berasal dari sumber tertentu disebut juga sebagai
radiasi elektromagnetik. Radiasi elektromagnetik yang dijumpai dalam
kehidupan sehari-hari adalah cahaya matahari.
Dalam
interaksi materi dengan cahaya atau radiasi elektromagnetik, radiasi
elektromagnetik kemungkinanan dihamburkan, diabsorbsi atau dihamburkan
sehingga dikenal adanya spektroskopi hamburan, spektroskopi absorbsi
ataupun spektroskopi emisi.
Pengertian spektroskopi dan spektrofotometri pada dasarnya sama yaitu di
dasarkan pada interaksi antara materi dengan radiasi elektromagnetik.
Namun pengertian spektrofotometri lebih spesifik atau pengertiannya
lebih sempit karena ditunjukan pada interaksi antara materi dengan
cahaya (baik yang dilihat maupun tidak terlihat). Sedangkan pengertian
spektroskopi lebih luas misalnya cahaya maupun medan magnet termasuk
gelombang elektromagnetik.
Radiasi elektromagnetik memiliki sifat ganda yang disebut sebagai sifat dualistik cahaya yaitu:
1) Sebagai gelombang
2) Sebagai partikel-partikel energi yang disebut foton.
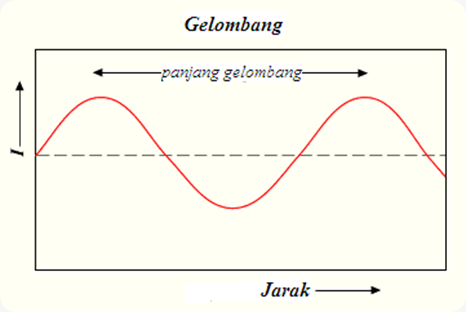
Karena sifat tersebut maka beberapa parameter perlu diketahui misalnya
panjang gelombang, frekuensi dan energi tiap foton. Panjang gelombang
(l) didefinisikan sebagai jarak antara dua puncak.
Hubungan dari ketiga parameter di atas dirumuskan oleh Planck yang dikenal dengan persamaan Planck. Hubungan antara panjang gelombang frekuensi dirumuskan sebagai
|
c = λ . v atau λ = c/v atau v = c/λ
|
Persamaan Planck: hubungan antara energi tiap foton dengan frekuensi
dimana
E = energi tiap foton
h = tetapan Planck (6,626 x 10-34 J.s),
v = frekuensi sinar
c = kecepatan cahaya (3 x 108 m.s-1).
Dari
rumus di atas dapat diketahui bahwa energi dan frekuensi suatu foton
akan berbanding terbalik dengan panjang gelombang tetapi energi yang
dimiliki suatu foton akan berbanding lurus dengan frekuensinya.
Misalnya: energi yang dihasilkan cahaya UV lebih besar dari pada energi yang dihasilkan sinar tampak.
Hal ini disebabkan UV memiliki panjang gelombang (λ) yang lebih pendek
(100–400 nm) dibanding panjang gelombang yang dimiliki sinar tampak
(400–800 nm).
Berbagai satuan energi beserta faktor konversinya dapat dilihat pada tabel:
|
Erg
|
Joule
|
Kalori
|
l.atm
|
E.volt
|
1 erg = 1
|
10-7
|
2,3901×10-8
|
9,8687×1010
|
6,2418×1011
|
J joule = 107
|
1
|
2,3901×10-1
|
9,8687×10-3
|
6,2418×1018
|
1 kalori 4,1849×107
|
4,1840
|
1
|
4,1291×10-2
|
2,6116×1019
|
1 atm = 1,0133×109
|
1,0133×102
|
24,218
|
1
|
16,6248×1020
|
1 E.volt = 1,6021×10-12
|
1,6021x-19
|
3,8291×10-20
|
1,5611×10-20
|
1
|
Interaksi antara materi dengan cahaya disini adalah terjadi penyerapan
cahaya, baik cahaya Uv, Vis maupun Ir oleh materi sehingga
spektrofotometri disebut juga sebagai spektroskopi absorbsi.
Dari 4 jenis spektrofotometri ini (UV, Vis, UV-Vis dan Ir) memiliki prinsip kerja yang sama yaitu “adanya interaksi antara materi dengan cahaya yang memiliki panjang gelombang tertentu”. Perbedaannya terletak pada panjang gelombang yang digunakan.
Secara sederhana Instrumen spektrofotometri yang disebut spektrofotometer terdiri dari :
sumber cahaya – monokromator – sel sampel – detektor – read out (pembaca).
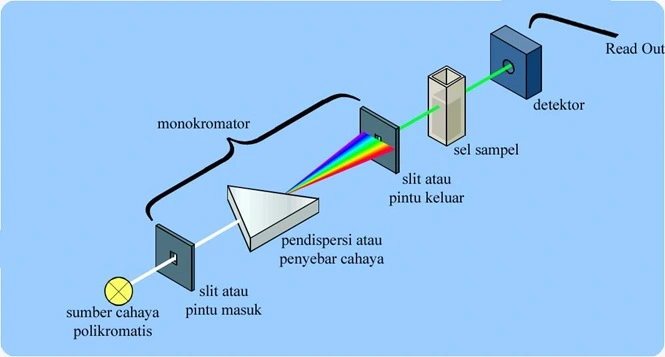
Fungsi masing-masing bagian:
1. Sumber sinar
polikromatis berfungsi sebagai sumber sinar polikromatis dengan
berbagai macam rentang panjang gelombang. Untuk sepktrofotometer
-
UV menggunakan lampu deuterium atau disebut juga heavi hidrogen
-
VIS menggunakan lampu tungsten yang sering disebut lampu wolfram
-
UV-VIS menggunan photodiode yang telah dilengkapi monokromator.
-
Infra merah, lampu pada panjang gelombang IR.
2. Monokromator
berfungsi sebagai penyeleksi panjang gelombang yaitu mengubah cahaya
yang berasal dari sumber sinar polikromatis menjadi cahaya
monaokromatis. Jenis monokromator yang saat ini banyak digunakan adalan
gratting atau lensa prisma dan filter optik.
Jika digunakan
grating maka cahaya akan dirubah menjadi spektrum cahaya. Sedangkan
filter optik berupa lensa berwarna sehingga cahaya yang diteruskan
sesuai dengan warnya lensa yang dikenai cahaya. Ada banyak lensa warna
dalam satu alat yang digunakan sesuai dengan jenis pemeriksaan.
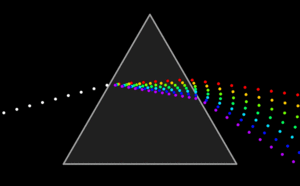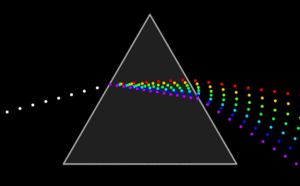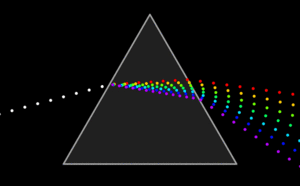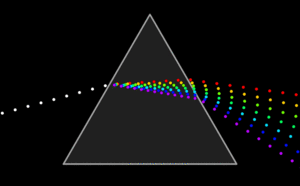
Pada
gambar di atas disebut sebagai pendispersi atau penyebar cahaya. dengan
adanya pendispersi hanya satu jenis cahaya atau cahaya dengan panjang
gelombang tunggal yang mengenai sel sampel. Pada gambar di atas hanya
cahaya hijau yang melewati pintu keluar. Proses dispersi atau penyebaran cahaya seperti yang tertera pada gambar.
3. Sel sampel berfungsi sebagai tempat meletakan sampel
- UV, VIS dan
UV-VIS menggunakan kuvet sebagai tempat sampel. Kuvet biasanya terbuat
dari kuarsa atau gelas, namun kuvet dari kuarsa yang terbuat dari silika
memiliki kualitas yang lebih baik. Hal ini disebabkan yang terbuat dari
kaca dan plastik dapat menyerap UV sehingga penggunaannya hanya pada
spektrofotometer sinar tampak (VIS). Cuvet biasanya berbentuk persegi
panjang dengan lebar 1 cm.
- IR, untuk
sampel cair dan padat (dalam bentuk pasta) biasanya dioleskan pada dua
lempeng natrium klorida. Untuk sampel dalam bentuk larutan dimasukan ke
dalam sel natrium klorida. Sel ini akan dipecahkan untuk mengambil
kembali larutan yang dianalisis, jika sampel yang dimiliki sangat
sedikit dan harganya mahal.
4. Detektor
berfungsi menangkap cahaya yang diteruskan dari sampel dan mengubahnya
menjadi arus listrik. Syarat-syarat sebuah detektor :
5. Read out merupakan suatu sistem baca yang menangkap besarnya isyarat listrik yang berasal dari detektor.
Proses Absorbsi Cahaya pada Spektrofotometri
Ketika cahaya dengan panjang berbagai panjang gelombang (cahaya
polikromatis) mengenai suatu zat, maka cahaya dengan panjang gelombang
tertentu saja yang akan diserap. Di dalam suatu molekul yang memegang
peranan penting adalah elektron valensi dari setiap atom yang ada hingga
terbentuk suatu materi. Elektron-elektron yang dimiliki oleh suatu
molekul dapat berpindah (eksitasi), berputar (rotasi) dan bergetar
(vibrasi) jika dikenai suatu energi.
Jika zat menyerap cahaya tampak dan UV maka akan terjadi perpindahan
elektron dari keadaan dasar menuju ke keadaan tereksitasi. Perpindahan
elektron ini disebut transisi elektronik. Apabila cahaya
yang diserap adalah cahaya inframerah maka elektron yang ada dalam atom
atau elektron ikatan pada suatu molekul dapat hanya akan bergetar
(vibrasi). Sedangkan gerakan berputar elektron terjadi pada energi yang
lebih rendah lagi misalnya pada gelombang radio.
Atas dasar inilah spektrofotometri dirancang untuk mengukur konsentrasi
suatu suatu yang ada dalam suatu sampel. Dimana zat yang ada dalam sel
sampel disinari dengan cahaya yang memiliki panjang gelombang tertentu.
Ketika cahaya mengenai sampel sebagian akan diserap, sebagian akan
dihamburkan dan sebagian lagi akan diteruskan.
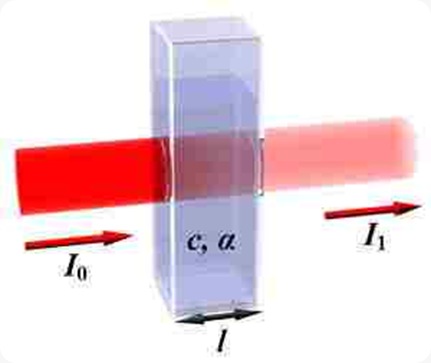
Pada spektrofotometri, cahaya datang atau cahaya masuk atau cahaya yang
mengenai permukaan zat dan cahaya setelah melewati zat tidak dapat
diukur, yang dapat diukur adalah It/I0 atau I0/It (perbandingan
cahaya datang dengan cahaya setelah melewati materi (sampel)). Proses
penyerapan cahaya oleh suatu zat dapat digambarkan sebagai berikut:
Gambar Proses
penyerapan cahaya oleh zat dalam sel sampel. dari gambar terlihat bahwa
zat sebelum melewati sel sampel lebih terang atau lebih banyak di
banding cahaya setelah melewati sel sampel
Cahaya yang diserap diukur sebagai absorbansi (A) sedangkan cahaya yang
hamburkan diukur sebagai transmitansi (T), dinyatakan dengan hukum
lambert-beer atau Hukum Beer, berbunyi:
“jumlah
radiasi cahaya tampak (ultraviolet, inframerah dan sebagainya) yang
diserap atau ditransmisikan oleh suatu larutan merupakan suatu fungsi
eksponen dari konsentrasi zat dan tebal larutan”.
Berdasarkan hukum Lambert-Beer, rumus yang digunakan untuk menghitung banyaknya cahaya yang hamburkan:
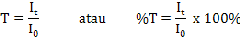 dan absorbansi dinyatakan dengan rumus:
dan absorbansi dinyatakan dengan rumus:
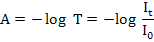
dimana I0 merupakan intensitas cahaya datang dan It atau I1 adalah intensitas cahaya setelah melewati sampel.
Rumus yang diturunkan dari Hukum Beer dapat ditulis sebagai:
|
A= a . b . c atau A = ε . b . c
|
dimana:
A = absorbansi
b atau terkadang digunakan l = tebal larutan (tebal kuvet diperhitungkan juga umumnya 1 cm)
c = konsentrasi larutan yang diukur
ε = tetapan absorptivitas molar (jika konsentrasi larutan yang diukur dalam molar)
a = tetapan absorptivitas (jika konsentrasi larutan yang diukur dalam ppm).
Secara eksperimen
hukum Lambert-beer akan terpenuhi apabila peralatan yang digunakan
memenuhi kriteria-kriteria berikut:
-
Sinar yang masuk atau sinar yang mengenai sel sampel berupa sinar dengan dengan panjang gelombang tunggal (monokromatis).
-
Penyerapan sinar oleh suatu
molekul yang ada di dalam larutan tidak dipengaruhi oleh molekul yang
lain yang ada bersama dalam satu larutan.
-
Penyerapan terjadi di dalam volume larutan yang luas penampang (tebal kuvet) yang sama.
-
Penyerapan tidak menghasilkan
pemancaran sinar pendafluor. Artinya larutan yang diukur harus
benar-benar jernih agar tidak terjadi hamburan cahaya oleh partikel-partikel koloid atau suspensi yang ada di dalam larutan.
-
Konsentrasi analit rendah. Karena apabila konsentrasi tinggi akan menggangu kelinearan grafik absorbansi versus konsntrasi.
Faktor-faktor yang
sering menyebabkan kesalahan dalam menggunakan spektrofotometer dalam
mengukur konsentrasi suatu analit:
-
Adanya serapan oleh pelarut.
Hal ini dapat diatasi dengan penggunaan blangko, yaitu larutan yang
berisi selain komponen yang akan dianalisis termasuk zat pembentuk warna.
-
Serapan oleh kuvet. Kuvet yang
ada biasanya dari bahan gelas atau kuarsa, namun kuvet dari kuarsa
memiliki kualitas yang lebih baik.
-
Kesalahan fotometrik normal
pada pengukuran dengan absorbansi sangat rendah atau sangat tinggi, hal
ini dapat diatur dengan pengaturan konsentrasi, sesuai dengan kisaran
sensitivitas dari alat yang digunakan (melalui pengenceran atau
pemekatan).
Spektrum UV, VIS, UV-VIS dan IR
Data-data yang
dikeluarkan oleh UV atau VIS dapat berupa absorbansi atau transmitansi
yang langsung dibaca pada spektrofotometer. Namun untuk UV, VIS, UV-VIS
dan IR data yang dikeluarkan dapat berupa spektrum jika telah
dihubungkan dengan komputer.
Spektrum yang
dikeluarkan oleh UV, VIS dan UV-VIS berupa pita yang lebar sedangkan
pada pita yang dikeluarkan oleh IR berupa garis atau puncak tajam.
Pita
melebar dari UV-VIS disebabkan karena energi yang dimiliki selain
menyebabkan transisi elektronik terjadi pula rotasi dan vibrasi elektron
dalam molekul. Sedangkan pada IR hanya terjadi vibrasi elektron maka
spektrum yang dihasilkan berupa garis atau puncak tajam. Selain pada IR, spektrum berupa garis dapat terjadi pula pada spektroskopi NMR karena hanya terjadi rotasi elektron.
Spektrum yang dihasilkan dari setiap spektroskopi berbeda antara satu dengan yang lainnya.
Para kimiawan spektrum UV, VIS maupun IR dapat dibedakan dengan mudah.
Spektrum yang dihasilkan oleh UV, VIS dan UV-VIS tidak berbeda jauh
namun sangat sangat berbeda bila dibanding spektrum IR. Untuk
membedakannya dapat dilihat pada gambar:
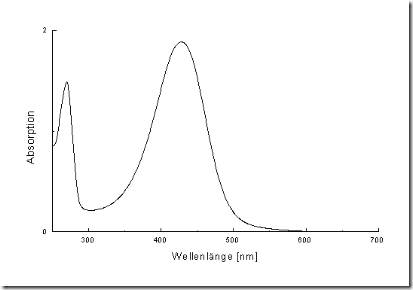
Gambar spektrum UV. Namun spektrum dari spektrofotometer VIS dan UV-VIS menyerupai spektrum UV
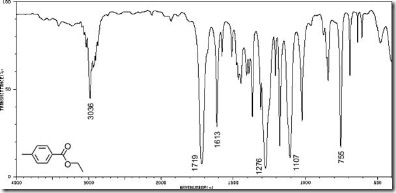
Gambar spektrum
IR. Pita tertinggi mengarah ke bawah sedangkan pada UV pita yang paling
tinggi mengarah ke atas hal ini disebabkan spektrofotometer IR ditulis
dalam bentung bilangan gelombang